发布时间:2019-09-05 发布人:学院办公室
8月15日,我院病原生物学系杨光教授的研究成果以“The GRA15 protein from Toxoplasma gondii enhances host defense responses by activating the interferon stimulator STING”为题,作为编辑精选文章(Editor Picks)发表于《Journal of biological chemistry》杂志.
地弓形虫是一种能够感染所有温血动物的有核细胞的原虫。在人类中能够建立长期慢性感染。全球约有30%的人口既往感染刚地弓形虫。在免疫缺陷病人中,潜伏感染的刚地弓形虫重新活化引起危及生命的弓形虫病。刚地弓形虫在宿主细胞内繁殖并通过一系列机制调控宿主免疫反应。以往有关识别刚地弓形虫受体的研究主要集中于Toll样受体。但细胞质中刚地弓形虫激活的受体及介导的信号通路仍有待阐释。
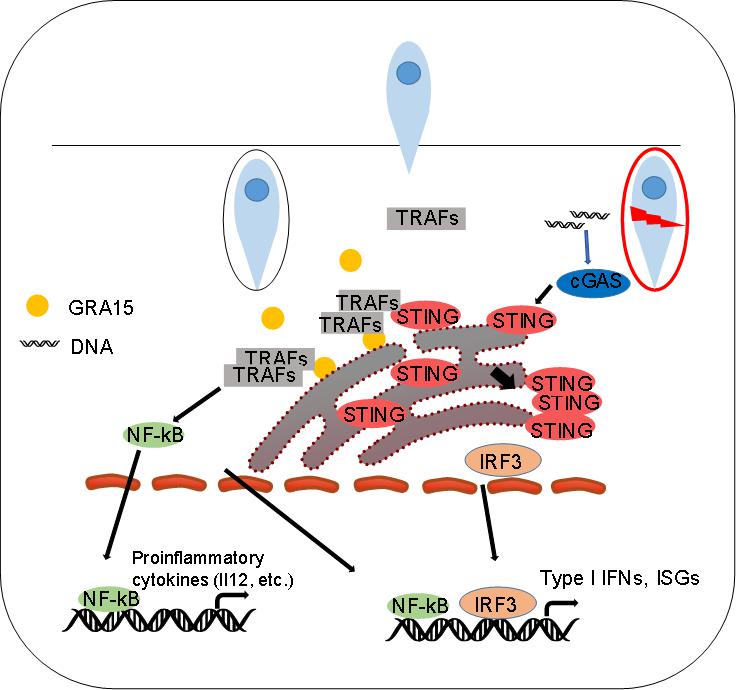
GRA15是一种弓形虫来源的致密颗粒蛋白,以往的研究表明,Ⅱ型刚地弓形虫来源的GRA15依赖TRAF6蛋白激活NF-kB信号通路,进而上调IL-12,IL-1β等细胞因子表达。本研究中,我们发现在小鼠模型中,双链DNA受体cGAS参与抗刚地弓形虫信号通路。我们还发现与野生型小鼠相比,STING敲除小鼠对刚地弓形虫更加易感。相应地,感染刚地弓形虫后,STING敲除小鼠的脾中不能有效表达炎症因子、Ⅰ型干扰素和干扰素刺激基因。与cGAS敲除小鼠相比,STING敲除小鼠感染刚地弓形虫后症状更严重。我们发现,刚地弓形虫来源的致密颗粒蛋白GRA15被分泌到宿主细胞质并通过第二跨膜区定位于内质网,进而激活STING从而激活天然免疫反应。进一步的机制研究表明,GRA15依赖TRAF蛋白促进了STING第337位赖氨酸的多聚泛素化和STING的寡聚化。相应地,与野生型刚地弓形虫相比,GRA15敲除的刚地弓形虫不能有效激活强烈的天然免疫反应。因此,GRA15缺失的刚地弓形虫毒性更强,感染野生型小鼠后小鼠死亡率更高。总之,刚地弓形虫感染激活cGAS/STING信号通路,GRA15依赖STING和TRAF蛋白增强该通路活性(图1)。
本研究被选为“Editors’ Picks”研究,是在每年6000多篇的JBC发表的文章中精选的前2%。(Our editorial board members and associate editors have determined your paper is in the top 2 percent of manuscripts they will review in a year in significance and overall importance. About 50 to 100 papers are selected from the more than 6,600 we publish each year.)
文章的通讯作者为我院病原生物学系杨光教授和我校讲座教授北京大学游富平研究员。我院为共同通讯作者单位。
文章链接:https://www.ncbi.nlm.nih.gov/pubmed/31416833
(基础医学院)