2020年5月20日,基础医学院血液学研究所兰雨研究员课题组的合作研究在人类巨噬细胞发育领域取得重要进展,题为“Deciphering Human Macrophage Development at Single-Cell Resolution”的研究成果在自然科学领域顶级期刊Nature在线发表。基础医学院边志磊博士后为论文的第一作者,兰雨研究员和我校“珠江学者”讲座教授刘兵研究员为论文的共同通讯作者,这是基础医学院首篇Nature文章。

巨噬细胞作为一种经典的固有免疫细胞,它种类多、分布广,在机体内扮演着“哨兵”、“敢死队”和“通讯员”等重要角色。除了为人熟知的免疫防御功能,巨噬细胞也发挥着一些重要的非免疫作用,例如在胚胎发育中它们还参与了造血微环境形成、骨和神经系统发育等。对于如此重要的细胞群体,我们不禁要问:“它从哪里来?又要到哪里去?”但我们发现很多时候越简单越本质的问题,反而是越难以准确作答。
相较于小鼠,人类巨噬细胞的起源和发育的研究一直以来困难重重,因为在发育早期巨噬细胞不但极其稀少,更无法示踪标记。但兰雨教授课题组经过多年科研积淀,终于拥有了揭开这个一直困扰科学界的谜团的“金钥匙”——单细胞组学技术。兰雨研究员聚焦血管与血液系统发育,与解放军总医院第五医学中心刘兵研究员(暨南大学讲座讲授)建立了长期合作以及研究生共同培养模式。双方课题组共同致力于造血发育与再生领域,此前已利用这把“金钥匙”,在人类造血干细胞和T淋巴细胞发育、小鼠造血干细胞发育的血管起源、功能异质性及lncRNA调控等方面合作取得一系列重要进展(Cell Stem Cell 2019;Immunity 2019;Cell Research 2017、2019、2020)。

细胞观察及讨论(左:边志磊博士后;中:兰雨研究员;右:刘兵研究员)

流式操作及讨论(左:刘兵研究员;中:边志磊博士后;右:兰雨研究员)
该研究通过高精度的单细胞转录组测序技术,绘制了人胚(孕8周内)造血细胞发育图谱;结合转录组、免疫表型和功能三个层面定义了人胚第一个具有多系分化潜能的造血祖细胞群体,即非造血干细胞来源的早期髓系祖细胞YSMP(yolk sac-derived myeloid-biased progenitor);精准解析了巨噬细胞尤其是小胶质细胞的起源和特化过程,包括明确了人胚期巨噬细胞的多重起源,以及组织驻留型巨噬细胞特化过程中的关键分子特征。这些重要的科学发现,不但解决了组织驻留型巨噬细胞“从哪里来到哪里去”的核心问题,更从单细胞层面解析了其逐渐蜕变转化的分子过程。该研究成果在为生命科学研究提供宝贵数据的同时,也为巨噬细胞相关疾病的诊断和治疗带来突破性的认识和进展。
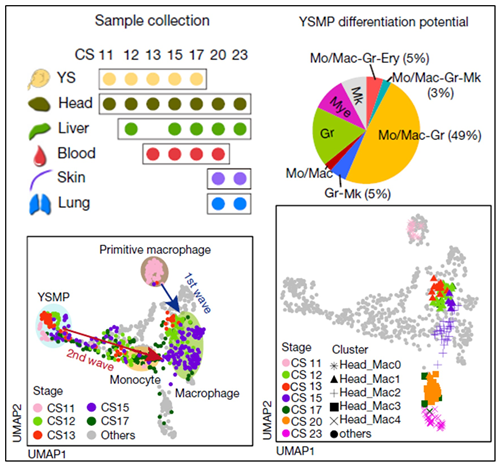
主要科学发现(左上:人胚细胞取材;右上:YSMP分化潜能构成;左下:人胚两波巨噬细胞起源;右下:人胚小胶质细胞特化过程)
新加坡免疫协作组(Singapore Immunology Network)/上海市免疫学研究所Florent Ginhoux教授为本文的共同通讯作者。军事科学院军事医学研究院的博士研究生公彦栋、黄涛、柏志杰、施卉,新加坡免疫协作组博士研究生Christopher Z.W.Lee,解放军总医院第五医学中心主任医师卞丽红为论文的共同第一作者。该项研究得到国家科技部、国家自然科学基金委和广东省“珠江人才计划”等科研项目的支持。边志磊博士是我院2017年引进的第三层次人才兰雨研究员招募的第一个博士后,该成果也是我校高水平大学建设引进人才的系列重要成果之一。

课题讨论(左起:侯思元博士后、刘兵研究员、兰雨研究员、边志磊博士后、博士研究生黄涛、博士研究生公彦栋)
原文链接:https://www.nature.com/articles/s41586-020-2316-7

![{{siteInfoList.info[5]}}](/_upload/tpl/06/0d/1549/template1549/images/logo.png)
