作为生命遗传物质的DNA是在DNA聚合酶作用下,以脱氧核糖核苷三磷酸(dNTPs)为原料聚合而成。dNTPs浓度平衡是保证DNA复制精确性和基因组稳定性的关键因素。细胞通过从头合成途径和补救途径获取dNTPs原料,其中从头合成途径是细胞利用dNTPs的主要来源。核糖核苷酸还原酶(Ribonucleotide Reductase,RNR)催化核苷二磷酸(NDP) 还原为脱氧核苷二磷酸(dNDP),这是dNTPs从头合成过程中最重要的限速性步骤。RNR是由大亚基RRM1和小亚基RRM2组成的异源四聚体。众所周知,DNA复制受到细胞周期的调控,发生于S期。为了保证dNTPs在S期的足量合成,小亚基RRM2蛋白水平在S/G2期显著高于G1期。但是,大亚基RRM1在细胞周期的不同阶段保持不变。除了上调RRM2蛋白水平外,人们对如何在S期特异激活RNR的其他分子机制仍然缺乏认识。

近日,我院陈果教授课题组在Oncogene 杂志(生物化学与分子生物学1区, IF=7.9)以Article形式发表了题为“Cell cycle-dependent phosphorylation of RRM1 ensures efficient DNA replication and regulates cancer vulnerability to ATR inhibition”的研究论文。该论文(如示意图)发现虽然RRM1蛋白水平在细胞周期进程中没有明显变化,但是检测到RRM1 在S期和G2早期能够被磷酸化,课题组进一步证实这种细胞周期依赖的RRM1磷酸化上游激酶是CDK2/CyclinA。同时鉴定其磷酸化位点为丝氨酸Ser559,通过结构分析发现Ser559位于RNR酶活反应中心,并采用体内体外酶活生化实验证实RRM1 Ser559磷酸化能够增强RNR酶活。磷酸化失活突变体S559A能够降低细胞内dNTPs水平、诱导DNA复制压力和染色体异常。并且,携带RRM1 S559A的细胞能够激活DNA损伤应激激酶ATR。抑制ATR能够使表达RRM1 S559A的细胞产生致死性的DNA复制压力,诱导细胞死亡。因此,通过RRM1磷酸化实现了S/G2期特异性激活RNR,通过这种方式保证了DNA复制过程中足量的dNTPs原料供给,为DNA复制保真性和基因组稳定性提供了新的分子机制。当CDK2/CyclinA介导的RRM1磷酸化失调时,会诱导明显DNA复制压力和DNA损伤,并增敏ATR抑制剂的抗肿瘤效率。
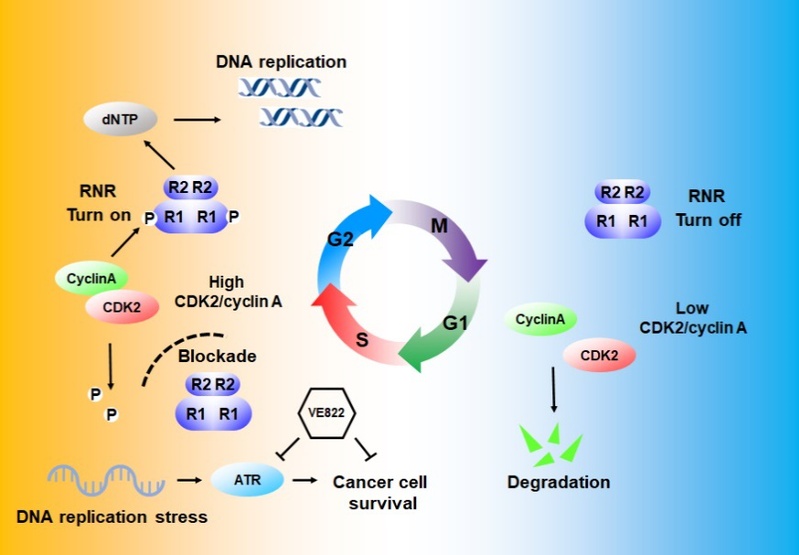
周期依赖性调控RRM1磷酸化作用示意图
该项工作受到广东省自然科学基金,广州市科技计划,中央高校科研基金以及国家自然科学基金的资助。陈果博士是该项工作的独立通讯作者,我院生化系是该项工作的第一完成单位。
(基础医学院)

![{{siteInfoList.info[5]}}](/_upload/tpl/06/0d/1549/template1549/images/logo.png)
