发布时间:2023-03-06 发布人:
近日,我院梅青松教授课题组以暨南大学为唯一通讯单位在Journal of the American Chemical Society发表了题为“Hydrophobicity Regulation of Energy Acceptors Confined in Mesoporous Silica Enabled Reversible Activation of Optogenetics for Closed-Loop Glycemic Control”的重要成果(图1)。

图1.文章标题页截图
光遗传学技术的发展为阿尔兹海默症、恶性肿瘤等疾病的诊疗提供了新的手段,然而,现有的光遗传学技术很难根据治疗过程中疾病标志物表达水平的动态变化来闭环调节治疗的强度和时间,容易导致光基因过度表达,引起疾病的恶化或降低疗效。鉴于此,梅青松教授课题组在前期上转换发光调控研究的基础上(Nature Commun.,2022,4741),设计了一种基于分析物诱导介孔内配体动态迁移策略的上转换发光可逆探针,其通过动态监测疾病标志物的实时浓度水平,自适应调控探针光强度,控制光基因表达水平,实现疾病的稳定、可控诊疗。
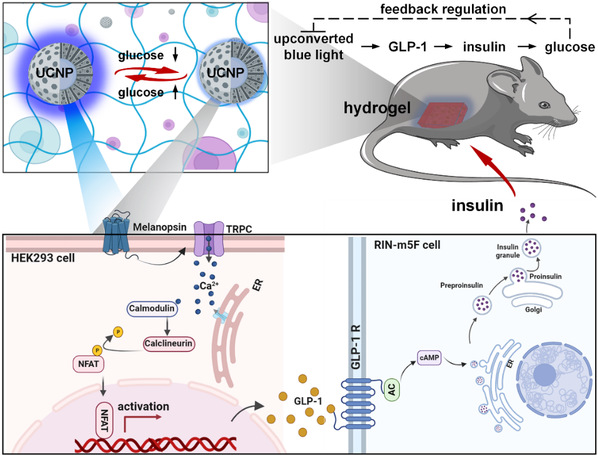
图2. 葡萄糖可逆探针用于自反馈调控光基因表达,实现血糖浓度的稳定控制
该项研究设计了一种在上转换纳米探针介孔二氧化硅层限域内配体疏水性动态调节介导的能量传递机制,以实现葡萄糖的实时动态监测。苯硼酸修饰的荧光素分子在与葡萄糖反应前后表现出可逆的疏水性质变化,从而使其在介孔二氧化硅层的疏水孔隙中实现可逆的内向/外向迁移,改变其与纳米颗粒能量传递效率,动态调整上转换发光颗粒的蓝光强度。进一步利用该可逆探针与光基因工程化细胞共同包裹形成水凝胶智能诊疗系统。上转换发光探针的蓝色荧光激活工程化细胞上对应的光敏蛋白,引发下游级联通路,使其合成胰高血糖素样肽-1(GLP-1),并刺激胰岛细胞合成胰岛素,降低血糖浓度。同时,血糖水平的降低会自反馈调节纳米探针的发光强度,减弱光遗传表达水平,避免过表达引起的低血糖。本文将化学与生物传感策略与光遗传合成生物学有机结合,为基于光遗传学的疾病诊疗提供了新的研究思路。
论文第一作者为暨南大学博士生卢麒,通讯作者为梅青松教授。该研究得到了国家自然科学基金、广东省自然科学杰出青年基金和暨南大学交叉学科培养等项目的资助。